Wasserhärte
Nach DIN 38409-6 gibt die Wasserhärte die Konzentration von bestimmten, durch die Härtebezeichnung festgelegten,
Ionen im Wasser an, so dass mit dem Begriff „Härte“ eine Eigenschaft des Wassers nummerisch ausgedrückt werden kann.
In Deutschland wird die Härte in Grad- deutscher-Härte (°dH) aufgezeigt.
Ein °dH entspricht einer Massenkonzentration von 10 mg Calciumoxid/Liter.
In Deutschland unterscheidet man 3 Härteberiche:
Weich –> < 8,4 °dH
Mittel –> 8,4 bis 14 °dH
Hart –> > 14 °dH
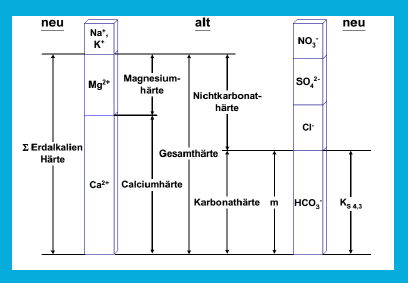
Desweiteren erfolgt eine Unterteilung in: Gesamthärte (GH)
Karbonathärte (KH)
Nichtkarbonathärte (NKH)
Die GH ist die Summe aus Calcium- und Magnesium-Gehalt und wird für die Härtebewertung eines Wassers herangezogen.
Die KH (vorübergehende Härte) ist die Summe der Molekülverbindungen zwischen Calcium- und Magnesium-Ionen und Hydrogenkarbonat.
Karbonate sind Salze deren Moleküle eine Anion-Verbindung mit einem CO32--Ion aufweisen. Erst in Verbindung mit Kohlensäure (H2CO3)
entstehen Hydrogenkarbonate, welche als Anion ein HCO3 –-Ionen enthalten.
Ab einer Temperatur von 60 °C gehen Hydrogenkarbonate in unlösliche Karbonate über, sodass diese ausfallen und gleichzeitig CO2 gebildet
wird. Daher wird die KH auch als vorübergehend betrachtet.
DieNKH (permanente Härte) kann durch eine Subtraktion der KH von der GH bestimmt werden:
NKH = GH – KH
Auswirkung auf den Brauprozess
Calcium (Ca2+): verbessern die Arbeit der stärkeabauenden Enzyme beim Maischen
Magnesium (Mg2+): in höherer Konzentration bitterer Geschmack
Natrium (Na+): in zu hoher Konzentration salzigen und/oder sauren Geschmack