Die Acidität
Der Begriff „Acidität“ fasst gelöste und nicht gelöste Säuren im Wasser zusammen.
Die Acidität (Konzentration der Säuren) ist demnach die Summe aller Säurebildner.
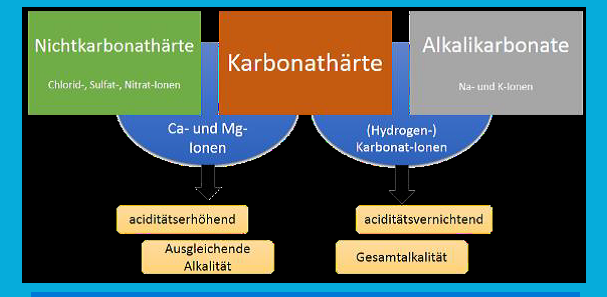
Die Acidität des Wassers wird durch drei Ionengruppen bestimmt:
1. aciditätserhöhende Calcium- und Magnesium-Ionen
2. aciditätsvernichtende Hydrogenkarbonat-Ionen
3. aciditätsneutrale Ionen
Calcium- und Magnesium-Ionen sind in der Karbonathärte als auch in der Nichtkarbonathärte vorhanden.
Ihre aciditätserhöhende Wirkung entsteht durch die Überführung von schwach alkalischen sekundären Phosphaten in saure primäre
Phosphate.
Aciditätsvernichtende Hydrogenkarbonat-Ionen sind in Verbindung mit Alkalimetallen Bestandteil der Karbonathärte
Die Alkalität
Das Gegenteil der „Acidität“ ist die „Alkalität“, welche die Konzentration der Basen (HCO3- -Ionen) erfasst.
Die Abbildung verdeutlicht, die Zusammenhänge der Erdalkali- und Alkalikarbonate, welche für die Gesamtalkalität ausschlaggebend
sind.